気体 の 体積 温度
昔 の 道具 霧吹きシャルルの法則と絶対温度 気体の体積と温度の関係. 「圧力を一定に保つとき、一定量の気体の体積は絶対温度に比例する」 式で表すと、 「圧力一定のとき、一定量の気体の体積Vは絶対温度Tに比例する。」 V=kT の関係を「シャルルの法則」といいます。 ※ PとかVとかTという記号が使われますが、 P は Pressure(圧力) V は Volume(体積) T は Temperature(温 … 詳細. 気体 の 体積 温度圧力、体積、温度の関係(ボイル・シャルルの法則) - 具体例 . 温度 が一定のとき、気体の 圧力 と 体積 は反比例します。 これをボイルの法則と言います。 つまり、 圧力を P P 、 体積を V V とすると、 PV =一定 P V = …. ボイル⋅シャルルの法則 わかりやすい高校物理の部屋. 気体 の 体積 温度実際にシャルルが実験で導き出した式は、一定の圧力において 0℃ のときの気体の体積を V0 [m 3 ]、セルシウス温度を t [℃]、そのときの体積を V [m 3] とし、. シャルルの法則 (セルシウス温度). V = V0(1 + 1 273 1 273 t) というもの でした。. 気体 の 体積 温度この式に絶対温度と . ボイル・シャルルの法則:圧力・体積・温度・物質量と気体の . 気体 の 体積 温度ボイルの法則とは、物質量と温度が一定の場合、圧力と体積のかけ算は等しいことを表します。 気体の状態方程式は以下のように表されます。 物質量と温度が同じであれ …. 第92章 気体の体積の変化 - Osaka Kyoiku. 1.温度が一定のとき,一定量の気体の体積は圧力に反比例する。 2.圧力一定のとき,一定量の気体の温度を変化させると体積は温度に対して直線上に変化する。1 の温度上昇(降下)で,体積は0 のときの体積の1/273だけ. 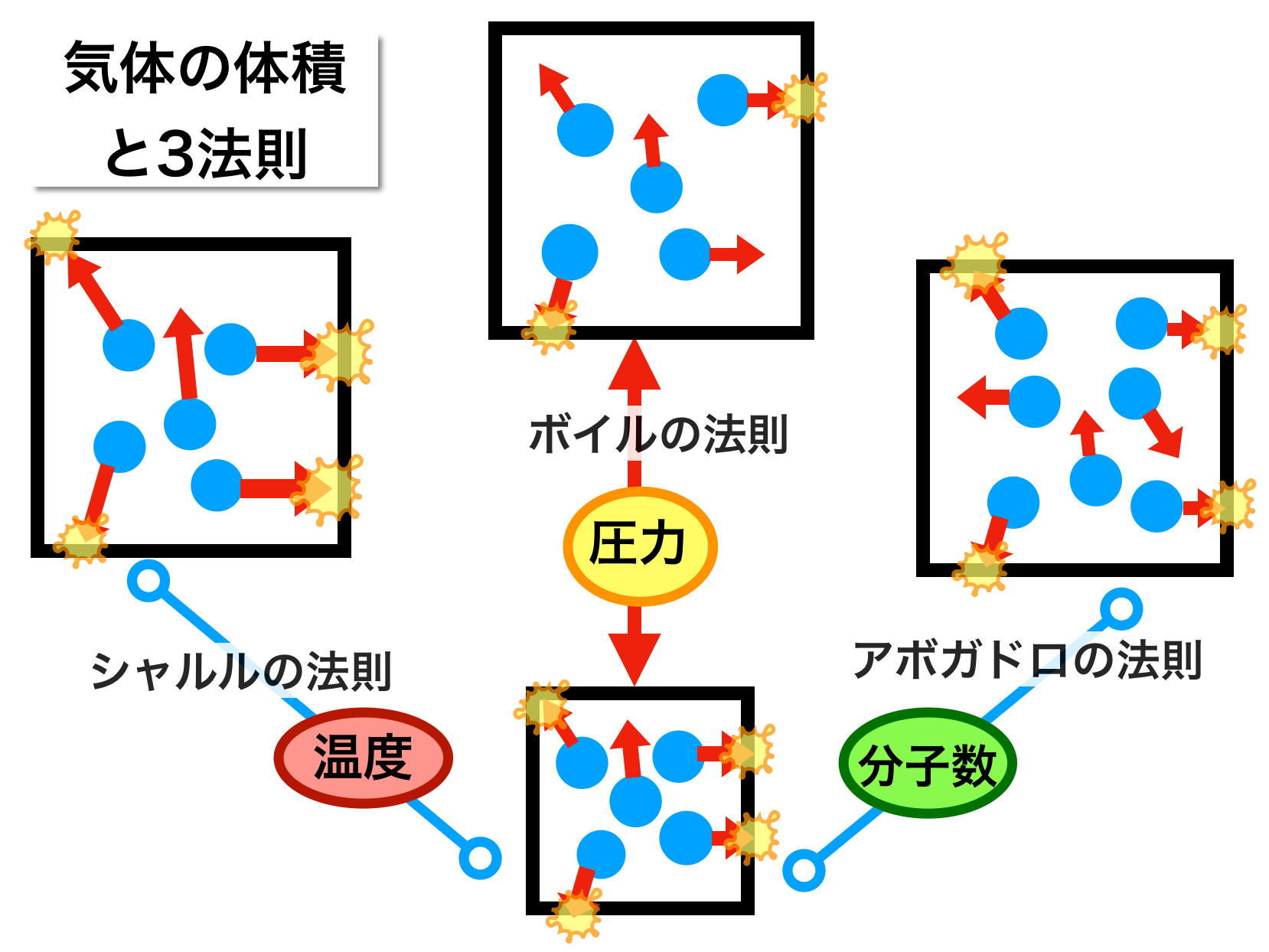
原田 学園 ことば の 支援 センターボイル・シャルルの法則とアボガドロの法則 | 図解で …. シャルルの法則 とは、圧力が一定のとき、 気体の体積 は 絶対温度 に 比例 するという法則のことです。 セ氏温度を基準にして表現すると1℃上昇するごとに0℃(273K)の体積の273分の1ずつ上昇するといえます。 気体の熱膨張 について表した法則でもあります。 温度が上昇するほ …. 気体 の 体積 温度理想気体と実在気体・状態方程式 | 理系ラボ. 気体の状態方程式. 気体 の 体積 温度1.1 気体定数. 気体の圧力を(P)、体積を(V)、絶対温度を(T)とします。 また、({rm 1mol})の気体の体積を(V_m)、({rm 1mol})の気体についての(k) …. 気体 - Wikipedia. 気体 (きたい、 英: gas )とは、 物質の状態 のひとつであり [1] 、一定の 形 と 体積 を持たず、自由に流動し 圧力 の増減で 体積 が容易に変化する状態のこと [1] 。 「ガ …. 気体 の 体積 温度ボイル・シャルルの法則とは?基本をわかりやすく解説 . 数式で表すと、V/T=一定 となります。 ここで、V は体積、T は絶対温度(ケルビン)です。 つまり、温度が上昇すると、体積も増加することになります …. 亀 の 子 スポンジ ホルダー
床 から の 立ち上がり 高齢 者ボイル・シャルルの法則(計算例題) | 理系ラボ. ボイルの法則. 温度が一定のもとでは、物質量が一定の気体について、圧力(P)は体積(V)に反比例する. ( displaystyle PV=k(一定) または P_1V_1=P_2V_2=k ) ただし …. ボイル・シャルルの法則 - KIT 金沢工業大学. 数寄屋 門 と は
水瀬 いのり 例 の 画像この式から, 気体の体積 V V は絶対温度 T T に比例し,圧力 p p に反比例する という関係にあることがわかる.また,このような関係が成り立つ気体を 理想気体 とい …. 【高校化学】ボイル・シャルルの法則のポイント | TEKIBO. 気体 の 体積 温度 
綾 地 寧々 ラーメン体積が一定のまま、温度や圧力が変化する状態変化を 定積変化 *. といいます。. これはピストンを固定しながらシリンダーを加熱、冷却するような状態変化です。. V が一 …. 気体の状態方程式とは?体積との関係から練習問題まで|高校 . 気体 の 体積 温度練習問題. 気体 の 体積 温度気体の状態方程式のまとめ. 気体の状態方程式とは. 気体 の 体積 温度気体の状態は、 圧力、体積、物質量、温度 で決まります。 これらの関係を表した式が、気 …. 気体の体積. 気体 の 体積 温度「 温度一定で,一定量の気体の体積 V は圧力 P に反比例する。 【気体の体積と温度(シャルルの法則)】 「圧力一定で,温度を 1 ℃上昇させるごとに,気体の体積は …. 気体 の 体積 温度気体の体積と物質量 – だいたいわかる高校化学(基礎). 気体は温度や圧力によって、体積が膨張したり収縮したりします。 そこで化学では気体のことを考察するとき、 標準状態 と呼ばれる条件をよく用います。 …. 物 理 化 学. ボイル温度は𝑇B= ウ となる。 図1は,異なる3つの温度におけるファン・デル・ワールス気体の圧縮因子の圧力 依存性を示している。いずれの温度においても圧縮因子は低 …. 第1回 流体の性質 | 日本機械学会誌 - jsme.or.jp. 本連載にあたって 機械工学に携わる技術者にとって「材料力学,機械力学,熱力学,流体力学」の4力学は,必須の重要な学問分野である.大学や高等専門学校等の機械工 …. 血液ガス分析の検体の取り扱い | 国立長寿医療研究センター. 気体の溶解度は 定温度で1気圧の気体が溶媒1mlに溶ける体積を標準状態に換算して表します。この溶解度は温度によって変化し、温度が くなるほど溶解度 …. ボイル=シャルルの法則 - Wikipedia. 気体 の 体積 温度概要 シャルルの法則、ボイルの法則、ゲイ=リュサックの法則を組み合わせたものである。 この法則の公式的な発見者はおらず、すでに発見されていた法則を融合させたものである。これらの法則は、気体の圧力、体積、絶対温度のうち任意の2変数が、その他の変数を定数として置いた場合 . 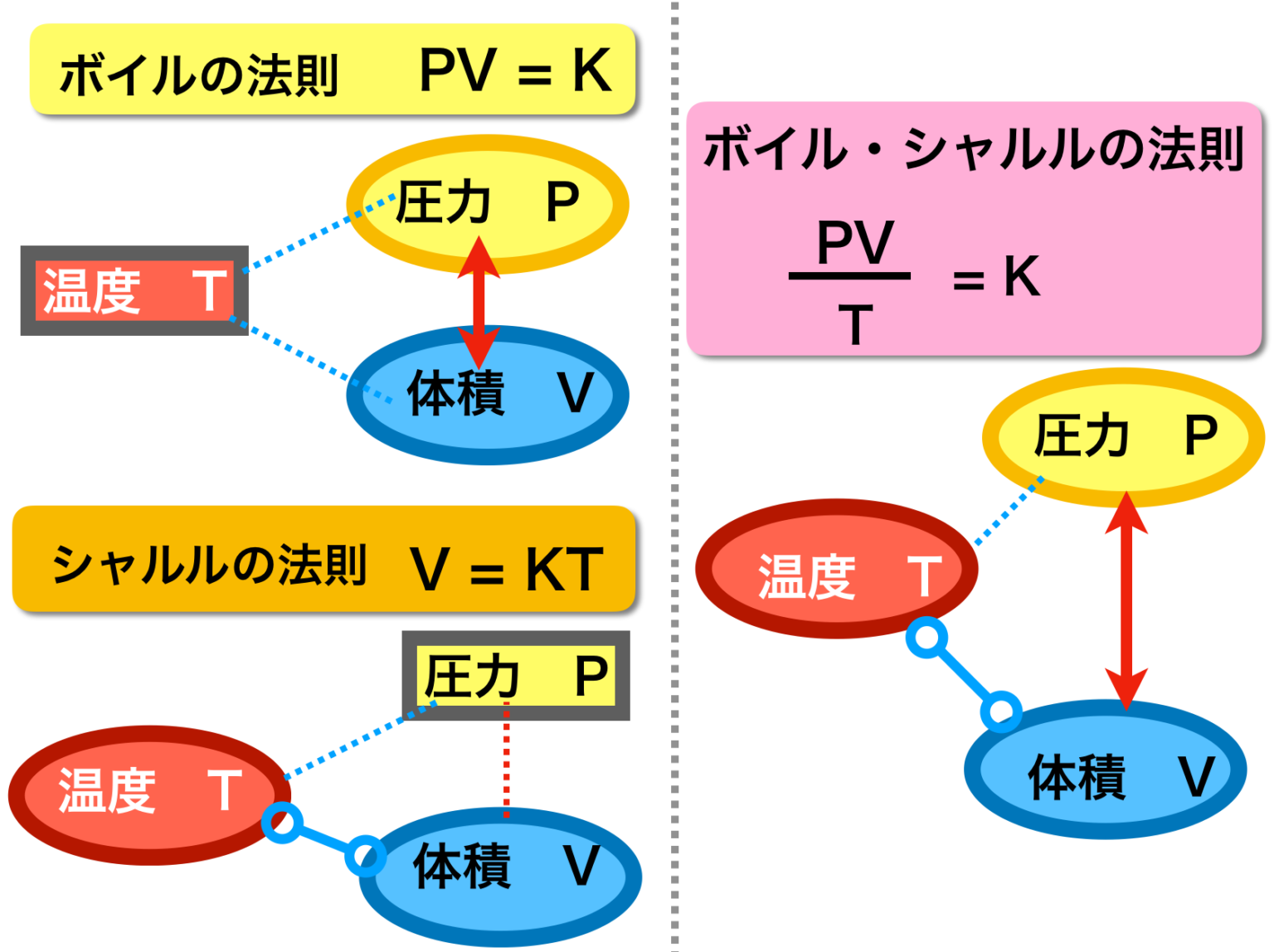
園 だ より 書き出し状態方程式|気体に関する圧力、体積、温度の関係 – Hitopedia. ボイル・シャルルの法則 ボイル・シャルルの法則とは、圧力と体積、温度の関係で、これに従う気体が理想気体である。 等温線 等温線は圧力と体積の積であるPVの等温変化を記述である。 理想気体ではボイルの法則によりPVが一定されるため、双曲線とよばれるシンプルな形となる。. 気体の膨張・収縮と温度との関係 計算問題を解いてみよう . 気体の膨張収縮と温度・圧力との関係 計算問題を解いてみよう【シャルルの法則】. り らく りら くる 違い
舌 の 裏 血管 正常科学的なデータを解析するときに、気体の体積変化や温度・圧力などの環境条件を考慮するケースが多くあります。. 実は、気体の温度や圧力が変化すると、気体が膨張し . 気体の状態変化とモル比熱(断熱変化,等温変化,定圧変化 . 気体の状態変化とは,気体の系において圧力,体積,温度が変化することを表します。 特に高校物理においては,熱力学第一法則とボイル・シャルルの法則を利用して,気体の状態がどのように変わるかを考察します。 なお,気体が外部から吸収した熱量を Q Q Q,Q Q Q による内部エネルギー . ボイル⋅シャルルの法則 わかりやすい高校物理の部屋. ボイルの法則のように、気体の温度が一定で圧力や体積が変化することを等温変化といいます。 シャルルの法則 一定量(左図では分子 4個)の気体をピストン付きシリンダーの中に入れ、 圧力 を一定に保ちながら、気体を 加熱 していくと、 体積 は大きくなっていきます。. ボイル・シャルルの法則 - 高校物理をあきらめる前に. 気体の圧力,体積,温度に関する考察をしていきます。例えば「圧力を変化させると温度はどうなるか」といった問題はどう考えればよいでしょうか? 力学 熱 波 電磁気 原子 熱 ボイル・シャルルの法則 YUKIMURA ここから先,いよいよ . 気体 の 体積 温度気体の状態方程式:状態図と蒸気圧曲線、質量・分子量の計算 . 気体の状態を表すとき、4つの要素が必要になることから、気体の状態方程式では圧力、体積、物質量、温度を利用します。圧力をP、体積をV、物質量をn、温度をTとすると、気体の状態方程式は以下のように表されます。. 理想気体 - Wikipedia. 理想気体の体積中で気体分子の占める体積は無視できるほど小さい。 実在気体では、圧力を一定に保ったまま温度を下げていくと、液体か固体に相転移する。あるいは、温度を一定に保ったまま圧力を上げても、液体か固体に相転移する. 気体の膨張とは?シャルルの法則とは? わかりやすく解説 . 気体の体積は、温度によって変化しますが、また、圧力によっても変化します。 それで、温度をかえたとき、気体の体積がどのように変化するかを調べるには圧力がかわらないようにしておいて、調べなければなりません。. 状態方程式の微分形 - EMANの熱力学. 全微分形式 理想気体の圧力, 体積, 温度を結びつける式については前に であるとした. 気体 の 体積 温度つまり,, の内の 2 つの量が決まれば, 残りの 1 つは自動的に決まってしまうということだ. 気体 の 体積 温度そこで, 体積 は温度 と圧力 の関数 であると考えて, 次のような式を作ることが出来る. 分圧の法則と計算問題 | 理系ラボ. 東大塾長の山田です。 このページでは「分圧の法則」について解説しています。 計算問題で間違えることがないように、計算問題の例題を使いながら詳しく解説しています。 是非参考にしてください。 1. 混合気体の体積と物質量 一定圧力 ( P . 空気の膨張とは何か?空気の温度によって体積が変化する . さて空気の温度によって体積が変化する仕組みを説明していきます。 まず前提として 空気だけでなくどんな物体においても温度というのは、 その物体の分子の運動によって決まっている ということを知っておかなければなりません。 分子が激しく動いていればその物体の温度は高くなり、. 気体 の 体積 温度物質量と気体の体積 巻出健太郎 - NHK | 日本放送協会. ての気体に共通する『アボガドロの法則』を紹介し,気体の体積や質量を表すには,その中に含 まれる粒子の個数に着目する物質量の考え方が . 液体が気体に変化する場合、体積は何倍になるか?. 気体 の 体積 温度液体が気体に変化する場合、体積は何倍になるかを計算してみる。 気体の体積は温度で大きく変化するので、沸点の時の体積とする。圧力は大気圧で一定とする。 水(H 2 O)の場合 水の分子量は 18 [g/mol]である。 液体の水の密度は 1. 熱力学第一法則:気体の内部エネルギーと仕事、温度の関係 . 熱を加えると気体分子は活発に動くようになります。言い換えると、熱によって分子のスピードが速くなります。 また熱を加えることによって分子の動きが活発化すると、体積が増えます。気体の体積が増えることにより、気体は仕事をします …. 等温・定圧・定積変化とP-Vグラフ | 高校物理の備忘録. 気体 の 体積 温度定積変化と P – V グラフ. 気体の状態変化を表す便利なP-Vグラフについて議論します. 気体 の 体積 温度P-Vグラフと熱力学第一法則をつかうだけで等温変化・定圧変化・定積変化のそれぞれについて, 内部エネルギーの変化・系が行う仕事・吸収する熱量を求めます. ボイルシャルルの法則ってなに?わかりやすく解説 | 受験物理ラボ. ボイルシャルルの法則は「一定量の気体の体積は気体の圧力に比例し、温度に反比例する」ことを表しています。ボイルシャルルの法則はその名前の通り「ボイルの法則」と「シャルルの法則」を組み合わせた法則です。それぞれの式が物理的にどんな意味を持つのか、高校生や受験生に向けて . 飽和蒸気圧とは?仕組みから徹底解説! │ 受験メモ. 飽和蒸気圧の定義. 気液平衡の状態では、. 温度と体積が一定ならいつも決まったモル数が気体になります。. 理想気体の状態方程式PV=nRTを思い出せば、. 温度と体積が一定ならいつも決まった圧力. 気体 の 体積 温度ということもできますね。. 気液平衡状態での圧力のことを . 体積の変換(温度補正あり) - 大東医療ガス. 1m 3 = 1000L(1リューベは1000リットル). 気体 の 体積 温度1cubic feet = 0.028316846592m 3. 気体の体積は、まわりの温度・圧力・湿度などの環境条件によって変化します. 一般的な高圧ガスの充てん量は35℃、1気圧に換算した体積です. ノルマルリューベ(Nm 3 )は0℃、1気圧 …. 木 枠 の 組み方
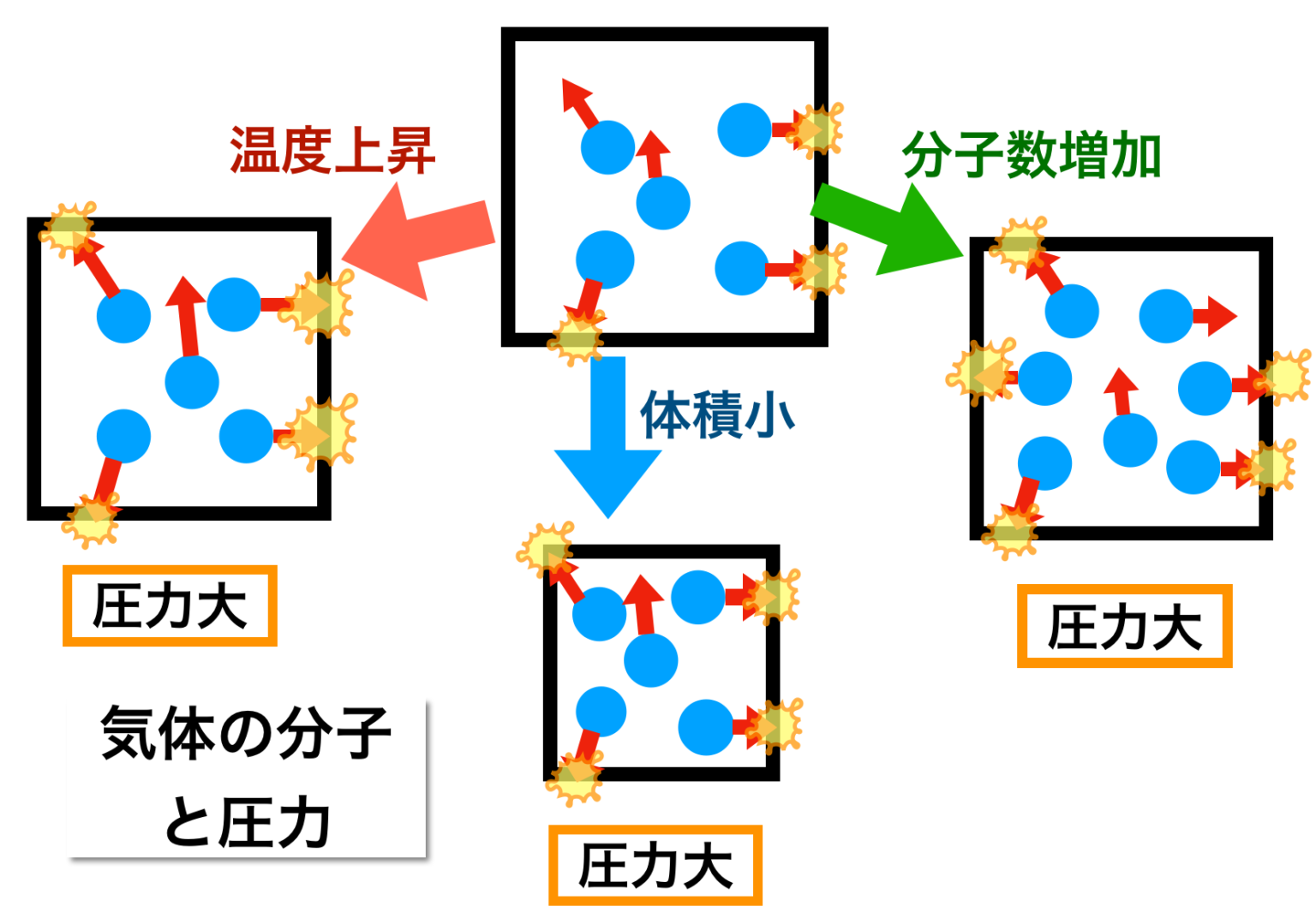
おしり の 割れ目 痛みボイル・シャルルの法則とは?基本をわかりやすく解説 . 気体 の 体積 温度ボイル・シャルルの法則とは? ボイル・シャルルの法則は、気体の状態を説明する基本的な物理法則で、ボイルの法則とシャルルの法則の両方を統合したものです。この法則は、一定量の理想気体において、圧力、体積、温度がどのように相互に関連しているかを示します。. 気体分子と体積の関係(ボイル・シャルルの法則とア …. 前回は気象を学ぶ上での基礎である 気体の温度、圧力、体積、分子数の関係について、圧力を中心に考えました。ここからは体積を中心に それらの関係を調べていきます。そして、そこからボイル・シャルルの法則の成立までを考えます。1.これから学ぶこと前. 物(固体・液体・気体)の体積(温度・空気)物理・ …. 気体 の 体積 温度物(固体・液体・気体)の体積と温度 物の体積は温度が変化すると変わります。 物は固体(氷)・液体(水)・気体(水蒸気)に分けられますが、 温度ともに変化する様子はそれぞれ違います。 固体・液体・気体、すべて(水は例外)温度が上がると体積が増えま …. 気体の状態変化 わかりやすい高校物理の部屋. 等温変化 温度が一定のまま、圧力や体積が変化する状態変化を等温変化* 定温過程、定温変化、等温過程など、いろいろな呼び名があります。 閉じる といいます。これは、熱を伝えやすい素材でできたシリンダーにおいて、ゆっくりとピストンを動かして常に内部と外部の温度を等 …. 気体の状態方程式 | 生物分子科学科 | 東邦大学. 気体の状態方程式 (perfect gas equation、ideal gas equation). 気体 の 体積 温度ボイルの法則(圧力依存性):温度一定、気体の質量一定のとき、圧力が高くなれば体積が小さくなる(気体の体積は、圧力に反比例する V ∝ 1/ p )。. または、 pV = 一定(温度一定、気体の質量一 …. 化学(気体の状態方程式)|技術情報館「SEKIGIN」|ボイル . 17 世紀の気体の性質に関する盛んな研究により,基本となるボイル・シャルルの法則「気体の圧力 P は体積 V に反比例し,熱力学的温度 T に比例する」が導き出されている。 PV / T = C(一定) この法則提案時には不明であった定数 C の正体は,次に示すように 18 世紀に進んだ原子・分子の概念 . 熱膨張率 - Wikipedia. 気体 の 体積 温度熱膨張率(ねつぼうちょうりつ、英: coefficient of thermal expansion[1]、略: CTE)は、温度の上昇によって物体の長さ・体積が膨張(熱膨張)する割合を、温度当たりで示したものである。熱膨張係数(ねつぼうちょうけいすう)[1]とも呼ばれる。温度の逆数の次 …. ボイル・シャルルの法則 - Osaka Kyoiku. そして、これを ボイル・シャルルの法則 といい、この法則に従う気体を理想気体といいます。. 理想と呼ぶのは、この法則が、あまりに温度が低かったり、圧力が高かったりすると成立しないためです。. また、この式から温度、圧力、体積が変化しても . 理想気体の状態方程式. 表.1 の関係において、十分に注意しなければならないことは、分圧というのは、飽くまで V と T を一定にして分離したときの成分気体の圧力であり、分体積もまた、 P と T を一定にして分離したときの成分気体の体積であることです。 よくある間違いとして、分圧の状態方程式を作るときに . 気体 の 体積 温度熱と温度 | 高校物理の備忘録. 脚注 1 今回議論するタイプの温度計の他にも, 体積が一定の状況下における気体の圧力, 高温に熱した物体の色, 個体の長さ, 電気抵抗の値などの温度計に利用可能な現象が存在している. 2 どんな気体を封入するのかを疑問に思った諸君は非常にするどい. 話 に 花 が 咲く 例文
ろりーた 種類標準状態 - 気体の体積 - わかりやすく解説 Weblio辞書. 気体 の 体積 温度気体の標準状態. 実在気体 の標準状態は、SSPの下にある純物質の理想気体である。. この状態は仮想的な状態である。. 例えば 298 K における H 2 O (gas) の標準状態は、10 5 Pa(または 1 atm)でも 凝縮 しない水蒸気であって、これは完全に仮想的な状態である . 公式のまとめ-熱力学篇- | 高校物理の備忘録. 気体の圧力が十分に低い場合, 気体の種類に関係なく次の2つの法則, ボイルの法則, シャルルの法則が成立する. ボイルの法則 とは, 温度 ( T ) を一定に保つと, 気体の圧力 ( P ) と体積 ( V ) の間に次式が成立することである. ヘンリーの法則とは?公式はどう使う?問題を解いて気体の . 4.【ヘンリーの法則の例題2】混合気体ではどう考える? 少し難しくなると、混合気体についての問題が出題されます。 ヘンリーの法則を使って、一つずつ整理していけば問題なく回答することができます。 例題 酸素と窒素の物質量が1:4の体積比で混合した 標準状態(0 、1.0×10 5 Pa)の 気体が . 中学受験理科「空気や水の温度と体積」最も体積が大きくなる . ものの温度が変化すると、体積はどのように変化するのでしょうか。. 今回は空気や水の温度と体積について学習します。. 「空気や水の温度と体積」基本問題 Q:ものの温度と体積について、以下の各問いに答えよ。. (1)下図のA、B、Cは、丸底フラスコにそ. 理想気体の状態方程式 - ばけライフ. 理想気体では無視される要素 それではどういう補正をしたらよいのでしょうか? 理想気体で無視しているが重要な要素は2つあります。 その1つ目は、分子の大きさです。 理想気体では、分子は質点として存在していますが、実際には、分子は必ず体積を持ちます。. 理想気体と実在気体の性質:分子間力と分子の体積による影響 . 気体 の 体積 温度理想気体では、分子間力と分子の体積が存在しないからです。. ただ、現実世界に存在するのは実在気体です。. そのため分子間力と分子の体積による影響により、 PV RT = 1 から値がずれます。. そこで、圧力や温度の変化によってどのように PV RT = 1 から値が . 絶対温度(K)はなぜ℃に273を足すの? - 受験化学の疑問を解決 . +273=絶対温度になる理由 絶対温度において にどうして273を足すのか?というと シャルルという研究者の実験が原点になっています。 シャルルという人は気体の体積と温度の関係を実験的に調べました。 風船を使って温度を1 上げたら、その風船の体積がどう変化するか調べました。. 気体の法則を使って計算しよう!「空気の質量」について理系 . 気体の体積が分かれば、質量を求めることができます。ただし、気体は同じ体積でも温度や圧力によって質量が変わってしまうもの。 同じ体積でも、ぎゅうぎゅうに圧縮した気体と、ほとんど圧縮していない気体では重さが異なるもの。. 生田 奈々 別名
しん た に 医院 小松ファン・デル・ワールスの状態方程式 | 高校物理の備忘録. 理想気体の等温曲線 [ P = frac{nRT}{V}] と比べると, ファン・デル・ワールス気体では温度 ( T ) が低い時の振る舞いが理想気体のそれと比べると著しく異なることは一目瞭然である.このような, ある温度 [2] 臨界温度という. よりも低いファン・デル・ワールス気体の振る舞いは上に示した図を . 飽和蒸気圧(求め方・温度との関係・計算問題の解き方など . 飽和蒸気圧とは. 気体 の 体積 温度密閉容器に液体を入れて十分時間が経つと「液体が気体になる量」と「気体が再び液体に戻る量」が一定となり、見かけ上、容器内の気体分子数に変化がなくなる( 気液平衡 )。. 気体 の 体積 温度このとき、温度と体積が一定であると仮定すると …. 理想気体の状態変化を解説:定容変化・定圧変化・等温変化 . 逆に気体が断熱圧縮して外部から仕事をされると、気体の体積Vは減少し気体の温度Tと圧力Pは増加します。 P-V線図 断熱変化をP-V線図で表すと下図のようになります。 1→2への変化前後でP、V、T全てが変化するため、P-V線図におい . 測定流体が気体の場合の温圧補正(気体のノルマル換算 . 測定状態の体積流量を固定換算で標準状態の体積流量に換算する場合、実際の温度、圧力、圧縮係数が固定換算に用いた値と異なると、換算係数の誤差分が換算誤差として生じます。 換算誤差を補正する場合は次のようになります。. 理想気体の状態方程式の計算や問題のコツをわかりやすく解説. 理想気体の状態方程式. 理想気体の状態方程式とは、PV=nRTで表される式です。. 仰向け で 寝る と 背中 が 痛い
ここでのPはpressure (圧力):単位 (Pa) VはVolume (体積):単位 (L) nは物質量:単位 (mol) Rは気体定数:単位 (Pa・L/K・mol)※あとで導出します。. TはTemperature (絶対温度):単位 (K)ケルビン . -273℃の時。物質の体積ってゼロになるんですか? - Yahoo . -273 で計算上体積がゼロになるのは気体だけ。物質でも液体や気体は計算上でも実際でも体積ゼロにはならない。 通常の温度では気体はぶつかり合って分子間距離を保っているが、その距離は分子自体の大きさに比べるとはるかに大きく、またその距離はケルビン温度(-273 を0度とする温度の . 【高校物理】熱力学の公式まとめ | 理系ラボ. 熱量保存則 :異なった温度の物体を接触させた時、しばらく時間がたった時全体が中間期な温度になる(熱平衡)。このとき、他との熱のやり取りがないとすると、 「低温物質が得た熱量=高温物質が失った熱量」 が成立する。 理想気体 . 混合気体の計算問題と公式 分圧と全圧と体積および物質量の関係.